Κ. Μόντη – Ιατρός
Abstract
Scientific research in recent years has brought man closer and closer to the mysteries of cell function and its reproductive mechanisms. In the middle of the last century, the science of Molecular Biology was born in Great Britain, which made a series of shocking discoveries, with the culmination of the discovery of the structure of DNA, the “code of life” on our planet.
Τον 5ο Π.Κ.Ε. αιώνα ο Ιπποκράτης χρησιμοποίησε για πρώτη φορά τους όρους «γόνος» και «γένος» όταν μιλώντας για την επιληψία (κείμενο «Περί Ιερής Νούσου»), ήθελε να διευκρινίσει ότι δεν επρόκειτο για θεόσταλτη νόσο αλλά για κληρονομικά μεταβιβαζόμενη («ως ο γόνος έρχεται παντόθεν του σώματος, από τε των υγιηρών υγιηρός και από των νοσερών νοσερός»).
Ο όρος γονίδιο (gene) καθιερώθηκε το 1902 από τον Δανό βοτανολόγο Wilhelm Johannsen, ως το «όχημα» μεταβίβασης κληρονομικών χαρακτηριστικών όπως αυτή καθοριζόταν από τους νόμους του πρωτοπόρου βοτανολόγου Mendel (1865). Το νόημα του γονιδίου βέβαια τότε στις αρχές του 20ού αιώνα ήταν θα λέγαμε «αφηρημένο», οριζόμενο μεν από τα φαινόμενα κληρονομικότητας που ερμήνευε, αλλά χωρίς «εικόνα» της υλικής του υπόστασης και ασφαλώς πολύ μακρινό ακόμη από οποιαδήποτε έννοια άμεσης παρέμβασης στη φύση και τη δράση του εκ μέρους του ανθρώπου. Η τότε επιστημονική παρέμβαση αφορούσε επιλογή των κατάλληλων γόνων προς διασταύρωση με σκοπό τον επιθυμητό φαινότυπο (τα φανερά δηλαδή χαρακτηριστικά ενός είδους) με μοναδικό μέσο την παρατήρηση των φαινοτύπων σε πολλαπλές διαδοχικές διασταυρώσεις.
Η επιστημονική έρευνα στα χρόνια που ακολούθησαν έφερε τον άνθρωπο όλο και πιο κοντά στα μυστήρια των λειτουργιών του κυττάρου και των μηχανισμών αναπαραγωγής του. Στα μέσα του προηγούμενου αιώνα γεννιέται η επιστήμη της Μοριακής Βιολογίας στη Μ Βρετανία, που πραγματοποίησε σειρά συγκλονιστικών ανακαλύψεων, με κορυφαία στιγμή την ανακάλυψη της δομής του DNA, του «κώδικα της ζωής» στον πλανήτη μας.
Το 1953 οι James Watson και Francis Crick δημοσίευσαν στο περιοδικό Nature ιστορικό άρθρο μικρότερο των χιλίων λέξεων στο οποίο περιέγραφαν την διπλή έλικα του DNA και τις υποθέσεις του για τους μηχανισμούς μεταγραφής του. Βραβεύτηκαν με το Nobel το 1962, μαζί με τον Maurice Wilkins που τότε στο ίδιο τεύχος είχε κάνει συναφή δημοσίευση (αφήνοντας δυστυχώς άδικα στη σκιά την εξίσου μεγάλη ερευνήτρια Rosalind Franklin, η οποία συγχρόνως με αυτούς είχε δημοσιεύσει παρόμοια συμπεράσματα, αλλά χάθηκε πρόωρα και μάλλον δεν είχε καλές δημόσιες σχέσεις…)
Από τότε η ανάπτυξη του κλάδου ήταν ραγδαία. Οι βασικές έννοιες της γενετικής έγιναν σχεδόν κοινό κτήμα και οι εφαρμογές των ανακαλύψεών της εισέβαλαν σε ολοένα και πιο ευαίσθητες περιοχές της γεωργίας και του περιβάλλοντος, της ιατρικής, ακόμη και της ίδιας της έννοιας της ζωής και των αξιών της. Το 2002 το Nobel ξανατίμησε την Βιοτεχνολογία (Sydney Brenner, Robert Horvitz, John Sulston) ενώ όλη η ανθρωπότητα συζητούσε το ζήτημα της κλωνοποίησης, ως θαύμα και ως απειλή.
Το DNA (δεσοξυ-ριβοζο-νουκλεονικό όξύ) είναι μια μεγαλομοριακή ένωση που αποτελείται από αζωτούχες-πρωτεϊνικές βάσεις, φωσφορικό οξύ και σάκχαρο. Παρόμοιας δομής ένωση είναι ο «συνεργάτης» του το RNA, με διαφορετικές μόνον τις πρωτείνες του. Βρίσκεται κυρίως μέσα στον πυρήνα του κυττάρου (βρέθηκε και σε άλλα όργανα του κυττάρου όπως τα μιτοχόνδρια) και είναι ο φορέας των γενετικών πληροφοριών του κυττάρου, όχι μόνον με την έννοια της μεταβίβασης χαρακτηριστικών, αλλά και της ρύθμισης της φυσιογνωμίας-εξειδίκευσης κάθε κυττάρου για την επιτέλεση των ιδιαίτερων λειτουργιών του. Η διαμόρφωση των μεγάλων μορίων του DNA έχει στο χώρο την μορφή δύο επιμήκων αλυσίδων οι οποίες συστρέφονται ελικοειδώς μεταξύ τους. Οι πρωτεϊνικές βάσεις του είναι μόνον 4 (κυτοσίνη, γουανίνη, θυμίνη, αδενίνη), οι οποίες ανάλογα με την σειρά αλληλουχίας τους σε τριάδες, κωδικοποιούν το μήνυμα για τη σύνθεση των πολυάριθμων αμινοξέων του κυττάρου (τα αμινοξέα ενωμένα συνθέτουν τις διάφορες πρωτεϊνες).
Οι λειτουργίες του DNA και οι μηχανισμοί του στον τρόπο έκφρασης, αντιγραφής, μεταγραφής, αυτοδιόρθωσης, ενεργοποίησης ή αναστολής, «σιωπής», μετάλλαξης, ποικιλότητας είναι αντικείμενο ενός από τα πιο συναρπαστικά ερευνητικά «ταξίδια», πόσο μάλιστα όταν ξέρουμε ότι το ταξίδι αυτό έχει μόλις αρχίσει… Επιγραμματικά για το θέμα μας θα πούμε ότι ο ρόλος του DNA είναι να κωδικοποιεί και να δίνει εντολές στο κύτταρο να επιτελεί τις γενικές αλλά και εξειδικευμένες λειτουργίες του ανάλογα με το όργανο στο οποίο ανήκει, και να διαφυλάσσει τις πληροφορίες αυτές για την μεταβίβασή τους στους απογόνους του. Ως γονίδια ορίστηκαν μικρά τμήματα του DNA που είναι υπεύθυνα για την σύνθεση συγκεκριμένων ουσιών ή την έκφραση ενός συγκεκριμένου χαρακτηριστικού. Δεν συνδέονται όμως τα βιολογικά γεγονότα με τα γονίδια με σχέση 1:1! Υπάρχουν βέβαια τα λεγόμενα μονογονιδιακά χαρακτηριστικά(ή νοσήματα όσον αφορά την Ιατρική), που καθορίζονται από την συμπεριφορά ενός μόνον γονιδίου, αλλά και πολλά άλλα πολυγονιδιακά, με πολύπλοκες και άγνωστες εν πολλοίς αλληλεπιδράσεις.
Μεγάλος ήταν ο ενθουσιασμός που μεταδόθηκε και από τα μέσα μαζικής ενημέρωσης για την πλήρη χαρτογράφηση του ανθρώπινου γονιδιώματος πριν λίγα χρόνια. Όχι αδικαιολόγητα βέβαια, μιας και έτσι η Ιατρική Γενετική απέκτησε την θεμελιώδη βάση αναφοράς για πάμπολλες έρευνες και εφαρμογές. Θα μπορούσαμε να πούμε ότι η σύγχρονη επιστήμη έμαθε όλο(;) το γενετικό αλφάβητο του ανθρώπινου οργανισμού.
Αρκεί όμως το αλφάβητο για να μιλήσει κανείς μια γλώσσα; Ποιες είναι «λέξεις» του γενετικού μας κώδικα; Ποια η «γραμματική» του; Ποιες είναι οι ειδικές «διάλεκτοι» του κάθε εξειδικευμένου κυττάρου; Ποιοι είναι οι «διερμηνείς» που εξασφαλίζουν την ενότητα του οργανισμού, πώς μπορούμε εμείς απέξω να «συνομιλήσουμε» και να ζητήσουμε από το κύτταρο να αλλάξει συμπεριφορά; Η (πρώτη τουλάχιστον) απάντηση βρίσκεται στις πρωτεϊνες! Αφού το μήνυμα του DNA-κώδικα είναι κατ αρχήν η σύνθεση πρωτείνών, οι λέξεις αυτής της γλώσσας είναι οι πρωτεϊνες, εμπνευστές και θεμέλιο του νέου κλάδου της πρωτεωμικής (proteomics). Η βασική βέβαια διαπίστωση στην οποία στηρίζεται είναι προφανές ότι δεν είναι καινούρια. Το καινούριο είναι οι σύγχρονες μέθοδοι της Μοριακής Βιολογίας και Βιοτεχνολογίας που έχουν κάνει την πρόσβαση σ αυτό το πεδίο δραματικά διαφορετική και ταχύτατη σε εξελίξεις και εφαρμογές.
Είναι προφανές πως η χαρτογράφηση του πρωτεώματος (του συνόλου δηλαδή των πρωτεϊνών των κυττάρων) παρουσιάζει και θα παρουσιάσει πολύ μεγαλύτερες δυσκολίες από αυτήν του γονιδιώματος, γιατί το πεδίο ερευνας είναι απείρως πολλαπλάσιο σε μέγεθος και πολυπλοκότητα: Κατ αρχήν η βιολογική «προσωπικότητα» μιας πρωτείνης δεν εξαρτάται απλώς από την γραμμική αλληλουχία των αμινοξέων της. Τα πρωτεϊνικά μεγαλομόρια έχουν τρισδιάστατη υπόσταση, με ιδιαίτερη διαμόρφωση στον χώρο, που απ’ αυτήν εξαρτώνται οι αλληλεπιδράσεις τους και η συμπεριφορά τους. Επίσης, γνωρίζοντας ότι το ανθρώπινο γονιδίωμα διαθέτοντας περί τα 40.000 γονίδια, κωδικοποιεί εκατοντάδες χιλιάδες διαφορετικές πρωτείνες, αντιλαμβανόμαστε ότι οι γενετικές πληροφορίες δεν είναι καθόλου σταθερές και μονοσήμαντες, και η έρευνα έχει ακόμη πολύ δρόμο μπροστά της, ίσως και μεγάλες εκπλήξεις ή ανθεκτικά μυστικά.
Η ταυτοποίηση ειδικών πρωτεϊνών και η παρασκευή τους με βιοτεχνολογικές μεθόδους δεν χρειαζόταν την πλήρη χαρτογράφηση του γονιδιώματος. Εδώ και πολλά χρόνια ήδη κάποιες «κρίσιμες» πρωτεϊνες αναγνωρίστηκαν και συσχετίστηκαν με την γενετική τους DNA-μήτρα με αποτέλεσμα να αναπτυχθούν εφαρμογές είτε σε διαγνωστικό επίπεδο (προγεννητικής διάγνωσης κληρονομικών νοσημάτων ή έγκαιρης διάγνωσης ασθενειών όπως ο καρκίνος) είτε σε θεραπευτικό (παρασκευή ινσουλίνης, ερυθροποιητίνης, εμβολίων κλπ). Εκτός βέβαια από τις καθαρά ιατρικές εφαρμογές, θα πρέπει να αναφέρουμε ότι επίσης έχουν αναπτυχθεί και αναπτύσσονται πολύπλευρες εφαρμογές στο χώρο των καλλιεργειών και της ζωοτροφίας, οι οποίες ίσως δεν φωτίζονται τόσο ζωηρά από τη δημοσιότητα όσο αυτές της ιατρικής, αλλά συχνά έχουν συνέπειες ή προοπτικές έως κοσμογονικές για το περιβάλλον και ασφαλώς και τον άνθρωπο και την υγεία του.
Οι εφαρμογές αυτές με τη βοήθεια σύγχρονων τεχνολογιών πολλαπλασιάζονται με ραγδαίους ρυθμούς και είναι σίγουρο πως θα ακούμε όλο και περισσότερα για τις επιτυχίες τους και τα προβλήματά τους. Εκτός από την «αμιγώς»(;) επιστημονική έρευνα διαφόρων Ακαδημαϊκών φορέων, στον τομέα έχουν επενδυθεί και επενδύονται συνεχώς τεράστια ποσά από ιδιωτικές εταιρείες, κυρίως φαρμακευτικές, ενδεικτικότατα του ενδιαφέροντος και των μελλοντικών εξελίξεων, αλλά και των δεοντολογικών διλημμάτων που θα προκύψουν (το ιδιωτικό κεφάλαιο κατά κανόνα «πατεντάρει» και μετατρέπει τα επιτεύγματά του σε ιδιοκτησία…).
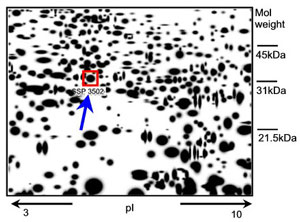
Οι τεχνικές που συνήθως χρησιμοποιούνται στις πρωτεωμικές μελέτες είναι η ηλεκτροφόρηση δύο διαστάσεων σε πολυακριμίδιο (2D-PAGE) και η φασματοσκοπία μάζας (mass spectrometry), οι οποίες διαχωρίζουν τις πρωτεϊνες ανάλογα με το μοριακό τους βάρος και το ηλεκτροχημικό τους φορτίο η πρώτη και ανάλογα με τη μάζα των ατόμων που τις αποτελούν η δεύτερη. Οι τεχνικές αυτές αποτυγχάνουν σε πολύ μικρές ή πολύ μεγάλες πρωτεϊνες και σε αυτές που απαντώνται σε μικρές ποσότητες. Τη λύση καλείται να δώσει η ρομποτική τεχνολογία, η οποία σε πολύ μικρότερους χρόνους θα πραγματοποιεί πρωτεωμικές αναλύσεις σε μεγάλη κλίμακα. Στην ίδια τεχνολογία επίσης έχουμε στραφεί για να ερευνήσουμε την τρισδιάστατη δομή των πρωτεϊνών στο χώρο, που όπως προαναφέραμε είναι απαραίτητο στοιχείο στην κατανόηση της συμπεριφοράς τους και στην δυνατότητα παρασκευής εξειδικευμένων χημικών μορίων που θα αποτελέσουν τη νέα γενιά φαρμάκων. Ο προσδιορισμός της τρισδιάστατης αυτής δομής γίνεται σήμερα με κρυστάλλωση των πρωτεϊνών που αναλύονται στη συνέχεια με ακτίνες Χ (κρυσταλλογράφημα).
Μερικές από τις νέες τεχνικές της πρωτεωμικής είναι η διαφορική ηλεκτροφόρηση μέσα στο πήκτωμα (differential in-gel electrophoresis, DIGE), η τεχνολογία πολυπαραγοντικής πρωτεϊνικής ταυτοποίησης (multidimensional protein identification technology, MudPIT) και η τεχνολογία φασματοσκοπίας μάζας (surface-enhanced LASER disorption ionization time-of-flight, SELDI-TOF). Η τελευταία μέσα σε λίγα λεπτά ανάλυσης δίνει έναν γραμμικό κώδικα (bar code) πρωτεωμικού αποτυπώματος του εξεταζόμενου βιολογικού δείγματος. Πλεονεκτήματα αυτής της μεθόδου είναι η ταχύτητα εκτέλεσης και η μικρή ποσότητα απαιτούμενου δείγματος και έχει εφαρμοστεί στον έλεγχο για τον καρκίνο του προστάτη (πρωτεϊνη PSA).
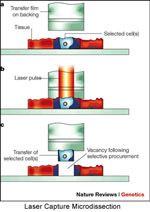
Ο καρκίνος είναι το κατεξοχήν δημοφιλές πεδίο έρευνας μέσω πρωτεωμικής. Το καρκινικό κύτταρο, μεταλασσόμενο όσον αφορά το γενετικό του υλικό, υπερ- ή υπο- παράγει κάποιες πρωτεϊνες, ή παράγει τροποποιημένες μορφές τους, οι οποίες μπορούν να ανιχνεύονται σε ιστούς ή βιολογικά υγρά. Η έγκαιρη ανίχνευση αυτών των αλλαγών του πρωτεώματος του καρκινικού κυττάρου θα αποτελέσει το νέο όπλο κατά της νόσου, με την έννοια της πρώιμης διάγνωσης αλλοιώσεων πολύ μικρής έκτασης. Οσο όμως πιο έγκαιρη επιδιώκουμε τη διάγνωση, τόσο πιο μικρό θα είναι το διαθέσιμο βιολογικό δείγμα. Η μικρή έκταση των πρώτων καρκινικών αλλοιώσεων, μπορεί να δυσχεράνει την λήψη σωστού δείγματος, δηλαδή να μπαίνει υπό εξέταση γειτονικός υγιής ιστός. Σε κάποιες τέτοιες περιπτώσεις έχει χρησιμοποιηθεί με επιτυχία η μέθοδος τεχνικής εκτομής με LASER κατά τη διάρκεια μικροσκόπησης (LASER capture microdissection, LCM), η οποία επιτρέπει την λήψη αμιγώς παθολογικού ή υγιούς ιστού σε μικροσκοπικό επίπεδο. Η μέθοδος αυτή χρησιμοποιήθηκε σε μελέτη όγκων των ωοθηκών χαμηλής κακοήθειας. Η κατεύθυνση στην οποία κινείται η σύγχρονη έρευνα είναι με εξέταση ακόμη και απλών σωματικών υγρών όπως το αίμα ή τα ούρα, να γίνεται πρώιμη ανίχνευση όγκων πριν αυτός γίνει κλινικά αντιληπτός.
Εκτός από την πρώιμη διάγνωση, οι σύγχρονες βιοτεχνολογικές μέθοδοι μελέτης του γονιδιώματος και πρωτεώματος του καρκινικού κυττάρου υπόσχονται και εξελίξεις στην παρασκευή κατάλληλων θεραπευτικών φαρμάκων. Ο όρος στοχοφάρμακα ήδη αποδίδεται σε πάνω από 500 μέχρι σήμερα φαρμακευτικές ουσίες με δράση εξειδικευμένη σε μοριακό επίπεδο λειτουργίας του γενετικού κώδικα ή των πρωτεϊνών που παράγει. Οι προοπτικές της στοχοθεραπείας ακούγονται ιδιαίτερα ενθαρρυντικές, με σκοπό τον περιορισμό της πολυφαρμακίας και την ανάπτυξη «έξυπνων» εκλεκτικών φαρμάκων χωρίς ανεπιθύμητες παράλληλες ενέργειες. Στόχος τους όχι μόνον ο καρκίνος αλλά και πολλά ήδη γνωστά πολυγονιδιακά νοσήματα όπως η υπέρταση, το μεταβολικό σύνδρομο, τα αυτοάνοσα και αλλεργικά νοσήματα κλπ. Ειδικά για τον καρκίνο ακούγεται πολύ αισιόδοξη η διαπίστωση ότι μόνο 40-800 γονίδια εμπλέκονται στην καρκινογένεση, από τα οποία 1-10 σχετίζονται με πρωτογενείς βλάβες. Επίσης, φαίνεται να υπάρχει μεγάλη αλληλοεπικάλυψη γονιδίων που αφορούν πολλούς τύπους καρκίνων, δηλαδή ίσως στο μέλλον με λίγα στοχοφάρμακα θα ελέγχονται πολλοί τύποι της νόσου.
Αντικρύζουμε την αυγή μιας εντελώς διαφορετικής εποχής της Ιατρικής και της Βιολογίας γενικότερα. Εχουμε ήδη εισχωρήσει στον μικρόκοσμο του κυττάρου και των μοριακών του ενώσεων. Εχουμε ήδη μεταλλάξει μικροοργανισμούς, φυτά και ζώα για να αποκτήσουν επιθυμητές για μας ιδιότητες, είτε για διατροφική κατανάλωση, είτε για σύνθεση-παραγωγή ουσιών φαρμακολογικής χρήσης: πολλοί βιολογικοί οργανισμοί κάθε βαθμίδας ήδη από χρόνια έχουν δεχθεί εκ μέρους μας την «γενετική πειρατεία» της μεθόδου ανασύνδεσης του DNA των κυττάρων τους για να παράγουν σε βιομηχανικές ποσότητες για λογαριασμό μας ουσίες που χρησιμοποιούνται θεραπευτικά, χωρίς να χρειάζεται να τις συλλέγουμε από ανθρώπινους δότες. Ακόμη και ο ίδιος ο άνθρωπος γίνεται ο στόχος τέτοιων γενετικών παρεμβάσεων, με τις μεθόδους της προγεννητικής θεραπείας είτε σε αρχέγονο κυτταρικό στάδιο είτε σε εμβρυϊκό, ακόμη και αργότερα με την μεταμόσχευση μεταλλαγμένων κυττάρων για θεραπευτικούς σκοπούς.
Η γνώση μας και η παρέμβαση στο γονιδίωμα (η οποία και αυτή ασφαλώς βρίσκεται στα πρώτα της βήματα) συμπληρώνεται και διαπλέκεται τώρα και με την παρέμβαση στο πρωτέωμα του κυττάρου, δημιουργώντας μια τελείως διαφορετική βάση για την ερμηνεία και την αντιμετώπιση των βιολογικών φαινομένων και της ιατρικής επιστήμης. Η ευγονική της διασταύρωσης μπιζελιών και νυχτολούλουδων από τον Mendel ή της διασταύρωσης ζώων στην κτηνοτροφία είναι πλέον η λίθινη εποχή για την σύγχρονη Βιοτεχνολογία. Σε μια φύση που από μόνη της είναι η πηγή αυτόματων «αργών» μεταλλάξεων, ο άνθρωπος έρχεται να αξιολογήσει σύμφωνα με δικούς του σκοπούς το «σωστό» και το «λάθος» του κυττάρου και να το βάλει να δουλέψει γι αυτούς, προκαλώντας δικές του «καλές» γενετικές μετατροπές, σε χρόνο δραματικά μικρότερο και σε εύρος δραματικά μεγαλύτερο.
Η συζήτηση που μπορεί και πρέπει να ανοιχτεί σε αυτό το πεδίο είναι ατέλειωτη. Ζητήματα βιο-ηθικής έχουν ήδη προκύψει πολλά και με τον καιρό είναι προφανές πως θα προκύπτουν όλο και σοβαρότερα. Από το πόσα δικαιώματα ιδιοκτησίας μπορεί να εγείρει μια ιδιωτική επιχείρηση σε ένα γενετικό κωδίκιο ή μια πρωτεϊνη, από το πόσο δικαίωμα έχουμε στη χρήση των ζώων για τέτοιους σκοπούς, το τι επιπτώσεις στη συνολική οικολογική ισορροπία θα έχουν οι ενέργειές μας, μέχρι ζητήματα ευγονικής και συνολικότερα πολιτικής της επιστήμης ή πολιτικής χρησιμοποίησης επιστημονικών δεδομένων. Η ίδια η έννοια της ζωής και της ταυτότητας των βιολογικών ειδών στον πλανήτη μας τίθεται υπό αναθεώρηση, από την άποψη ότι στο στόχαστρό μας μπαίνει ο κυτταρικός μικρόκοσμος, με εφαρμογές που συχνά παραβιάζουν την ακεραιότητα της βιολογικής ταυτότητας των οργανισμών. Μονάδα της ζωής αξιώνεται να θεωρηθεί το γονίδιο και όχι καν το κύτταρο. Και αυτήν την «κάθοδο» στον μοριακό μικρόκοσμο ο άνθρωπος βολικά τη χρησιμοποιεί «ταπεινώνοντας» πολλά έμβια όντα, επιδιώκοντας για τον εαυτό του ύψιστο ενδιαφέρον για βιολογική ακεραιότητα και κυριαρχία, με υγεία και μακροζωία.
Χαρμόσυνες ειδήσεις ακούγονται μαζί με κώδωνες κινδύνου. Δεν είναι εύκολο να κρίνουμε την γνησιότητα ή την ορθότητα των μηνυμάτων αυτών πριν κριθούν τα πράγματα στην ιστορία, ούτε όμως συγχωρούμαστε να περιμένουμε παθητικά αυτήν την κρίση. Είναι δε σύνηθες και εξηγήσιμο να είναι ευπρόσδεκτες οι εξελίξεις όταν έχουν κυρίαρχα ιατρικό χαρακτήρα, όμως αυτός σε καμιά περίπτωση δεν αθωώνει a priori τις παρεμβάσεις μας στη φύση. Η επιστημονική έρευνα και οι εφαρμογές της μπορεί μερικές φορές να φαίνεται ότι έχουν μια δική τους «αυτόνομη» δυναμική, ανεξάρτητη εν πολλοίς από την πολιτική χρήσης τους. Ακόμη και αν αυτό ισχύει σε έναν βαθμό, ακόμη και αν δεχτούμε ότι γενικά το «ποτάμι δεν γυρίζει πίσω», άλλο τόσο ισχύει η ανάγκη της επαγρύπνησης για τον δρόμο που παίρνει αυτό το ποτάμι…
Ενδεικτικές Πηγές
Ζουμπουρλής Β., Σολακίδη Σ., Βλαχόπουλος Σ., «Πρωτεωμική: Ένα ισχυρό όπλο για την ανάλυση των φυσιολογικών και των παθογενετικών μηχανισμών σε μοριακό επίπεδο» στο Ογκολογική Ενημέρωση, 2003, Οκτ-Δεκ 5(4)
Μαρκέτος Σ., «Η 50η επέτειος της μοριακής δομής του DNA» στο Ογκολογική Ενημέρωση 2003, Απρ-Ιουν 5(2)
Rifklin J, Ο αιώνας της βιοτεχνολογίας, Νέα σύνορα, Αθήνα 1998.
Dawkins R., Το εγωιστικό γονίδιο, Σύναλμα, Αθήνα 1998,
Χρούσος Γ.Π., «Στοχοθεραπείες: Νέα θεραπευτική προσέγγιση», Εναρκτήρια ομιλία του καθηγ στην 37η Παιδιατρική ενημέρωση της Α΄ Παν/μιακής Παιδιατρικής Κλινικής Αθηνών. Δημοσιευθηκε στο δελτίο της Κλινικής τομος 51 τεύχος 3, Ιουλ-Σεπτεμβ 2004Proteomics. J Environ Pathol Toxicol Oncol 2004; 23(3):161-78
Proteomics in pathology, research and practice. Pathol Res Pract 2004; 200(2): 69-82
Proteomic profiling of cancer biomarkers. Brief Funct Genomic Proteomic 2003; Jul 2(2):147-58
Δημόσια βάση δεδομένων: www.ncbi.nlm.gov/SAGE/
© 2004 Κατερίνα Μόντη
 Licensed under a Creative Commons Attribution-ShareAlike 4.0 International License. Writers are the copyright holders of their work and have right to publish it elsewhere with any free or non free license they wish.
Licensed under a Creative Commons Attribution-ShareAlike 4.0 International License. Writers are the copyright holders of their work and have right to publish it elsewhere with any free or non free license they wish.
